News
-
2023/1/15
新しい研究成果がLife Sciences誌に掲載されました。
-
2022/08
Proceedings of the Japan Academy. Ser. B, Physical and Biological Sciences誌に体液恒常性維持機構に関する総説を発表しました。
-
2021/7/29
野田昌晴特任教授が第23回時実利彦記念賞を受賞しました。
-
2020/11/10
新しい研究成果がNature Communications誌に掲載されました。
Research
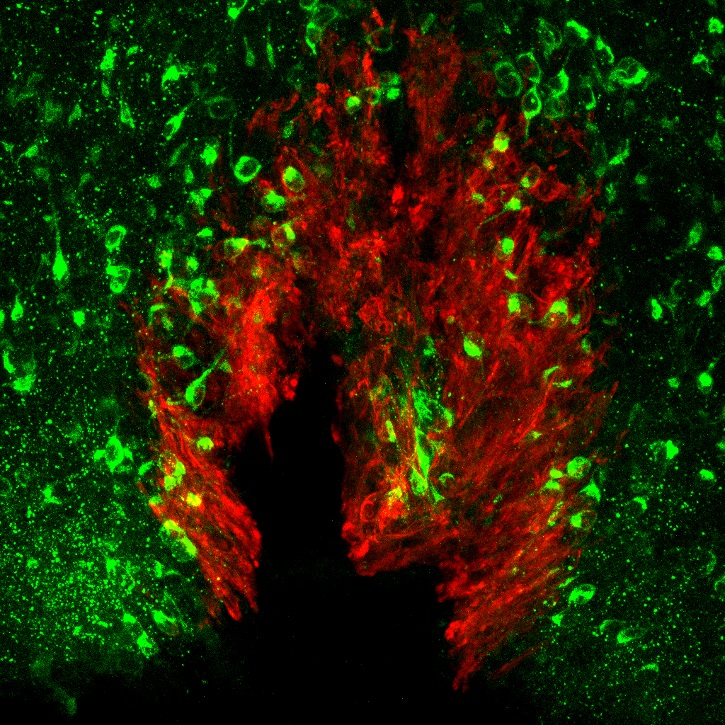
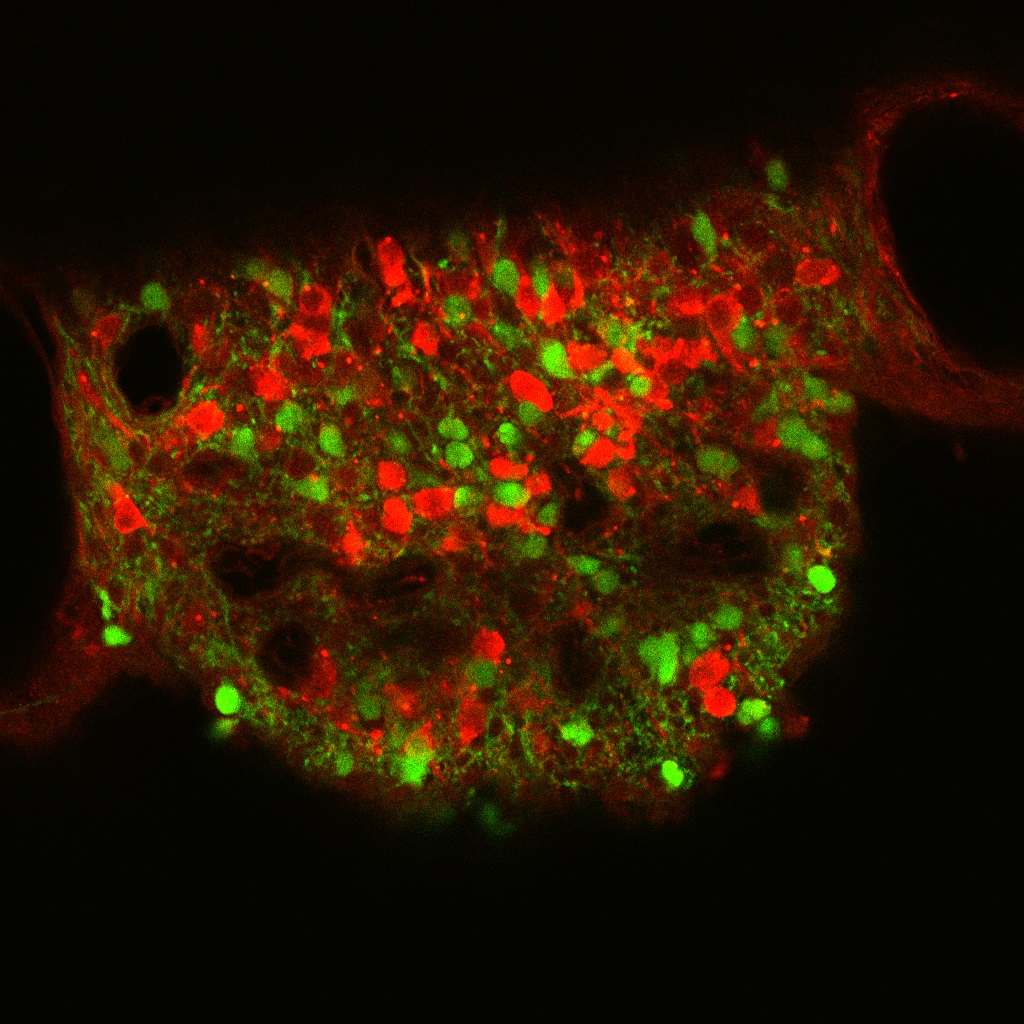
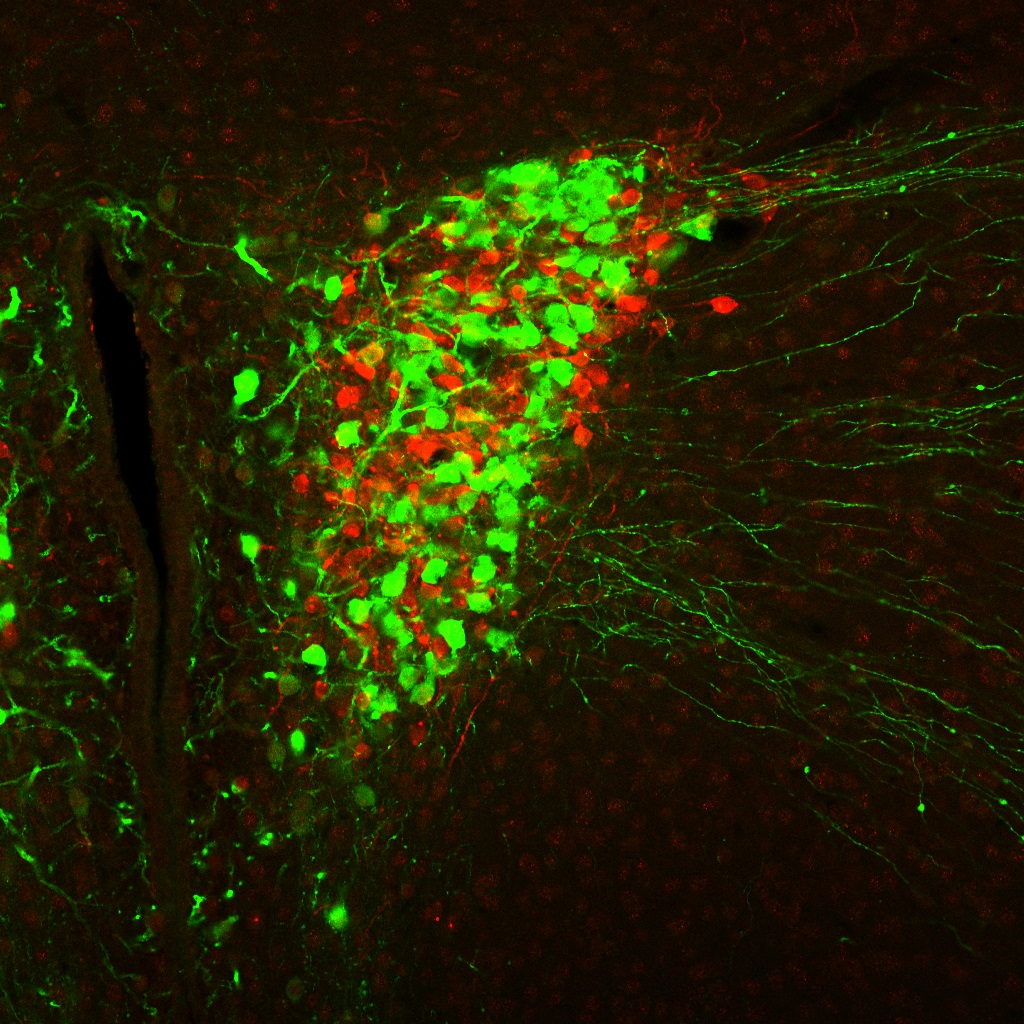
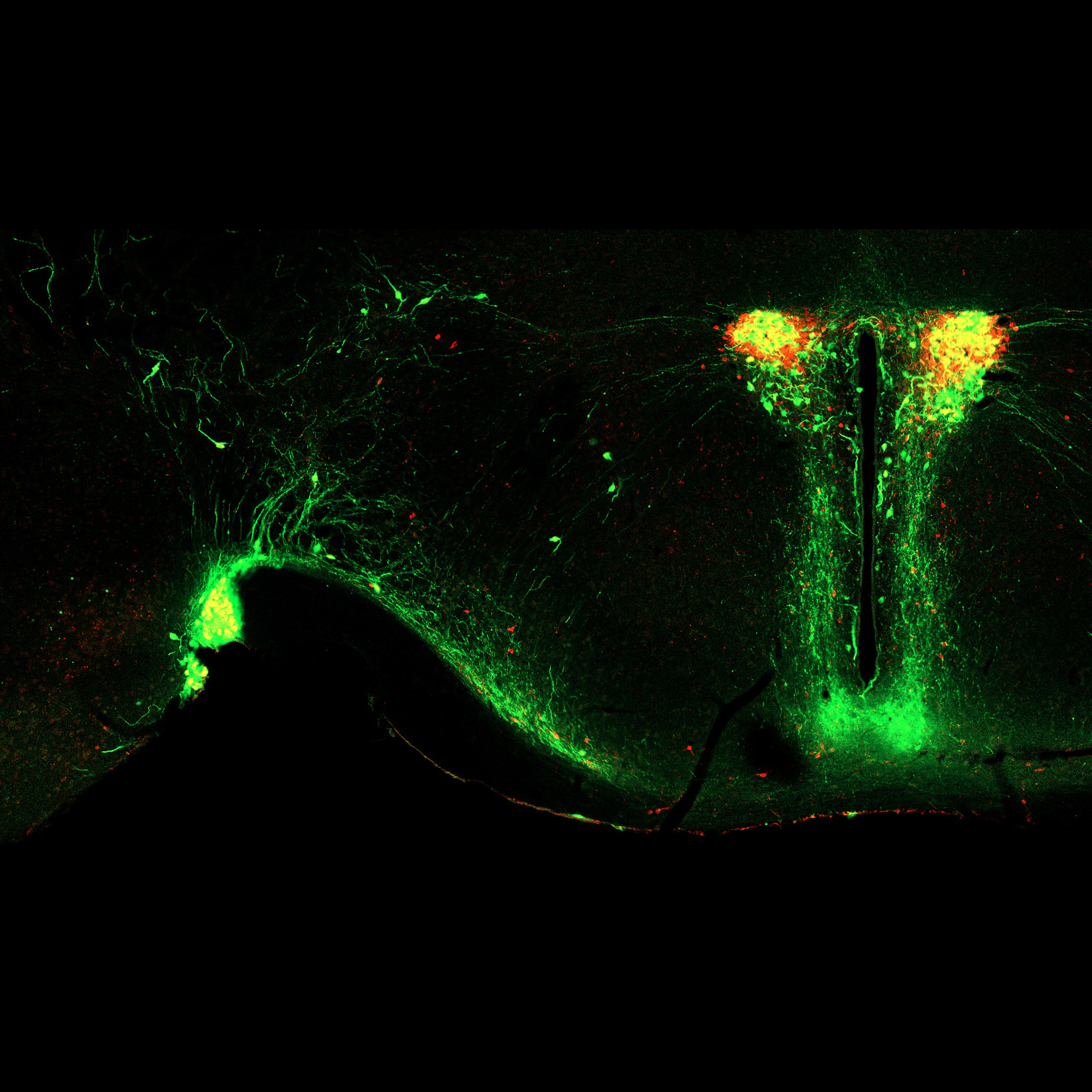
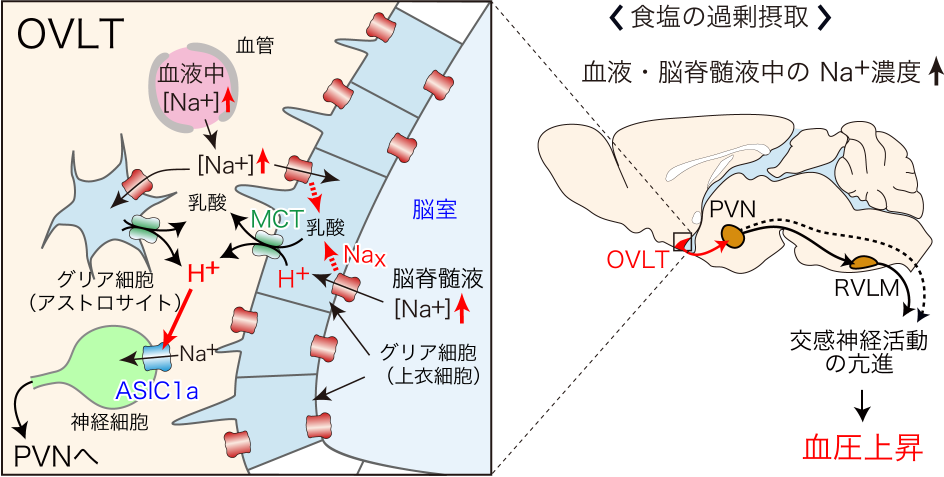
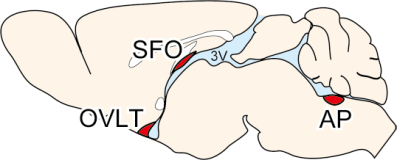
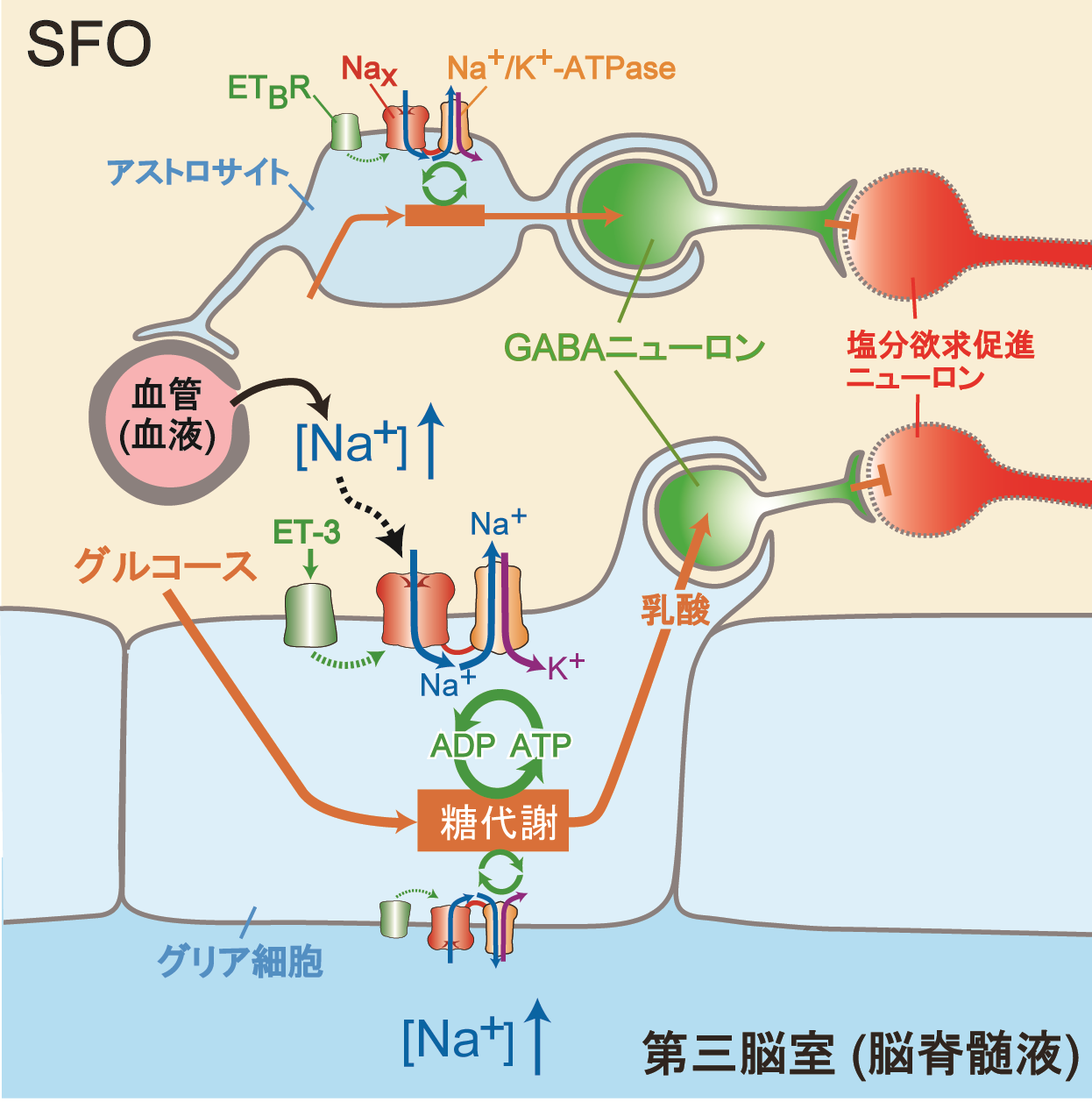
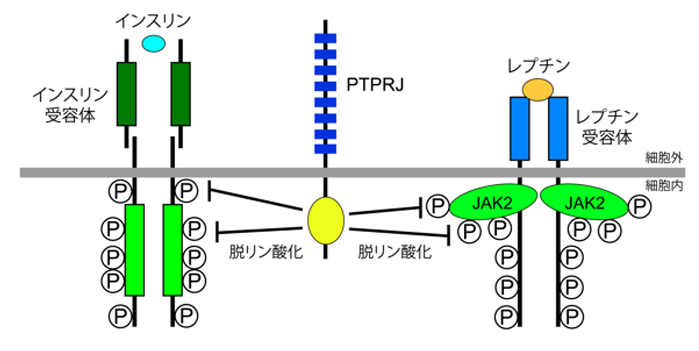
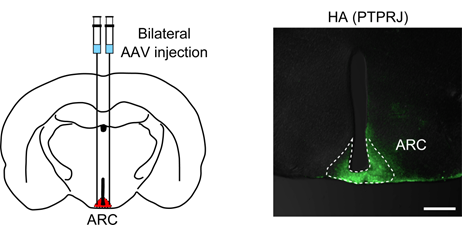
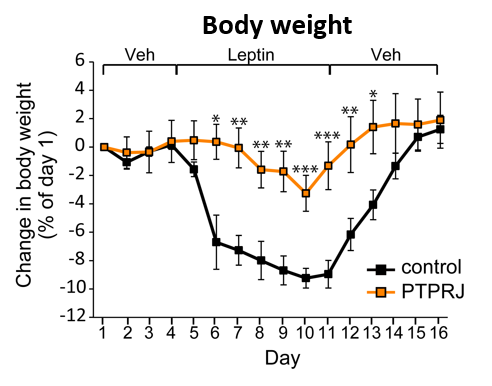
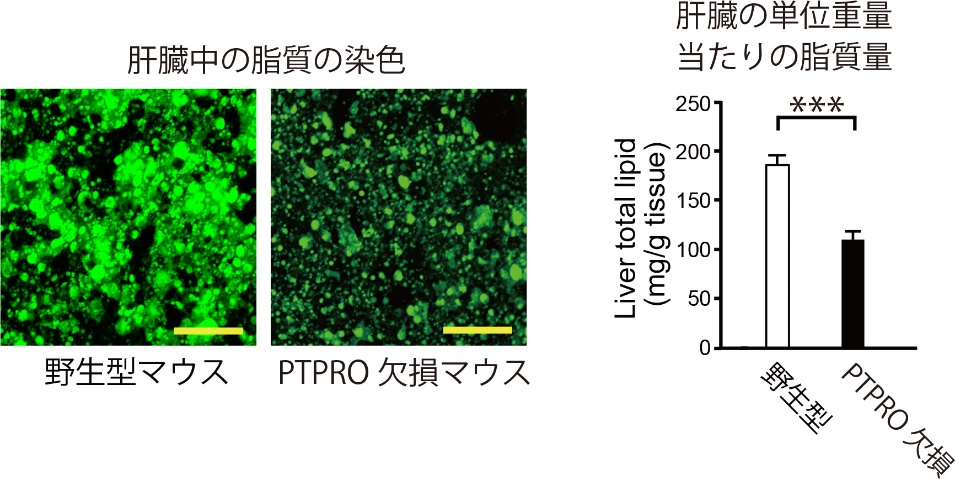
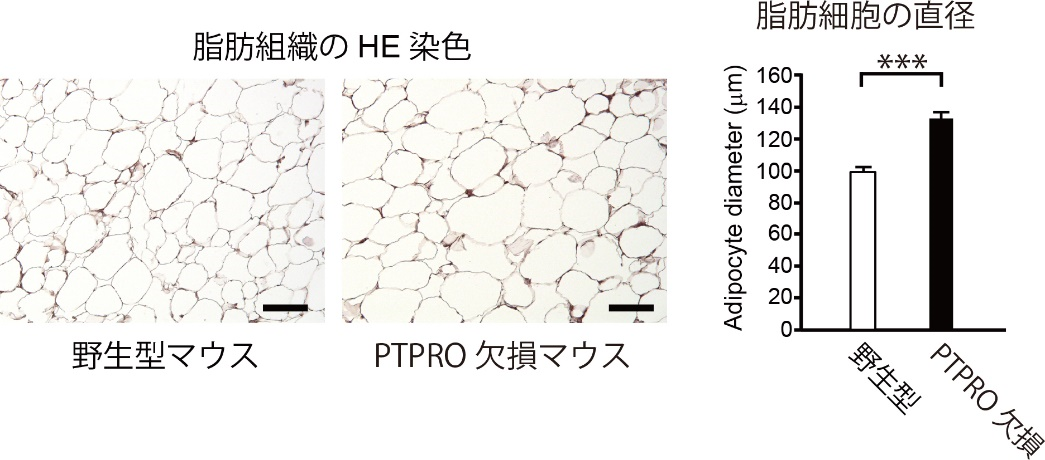
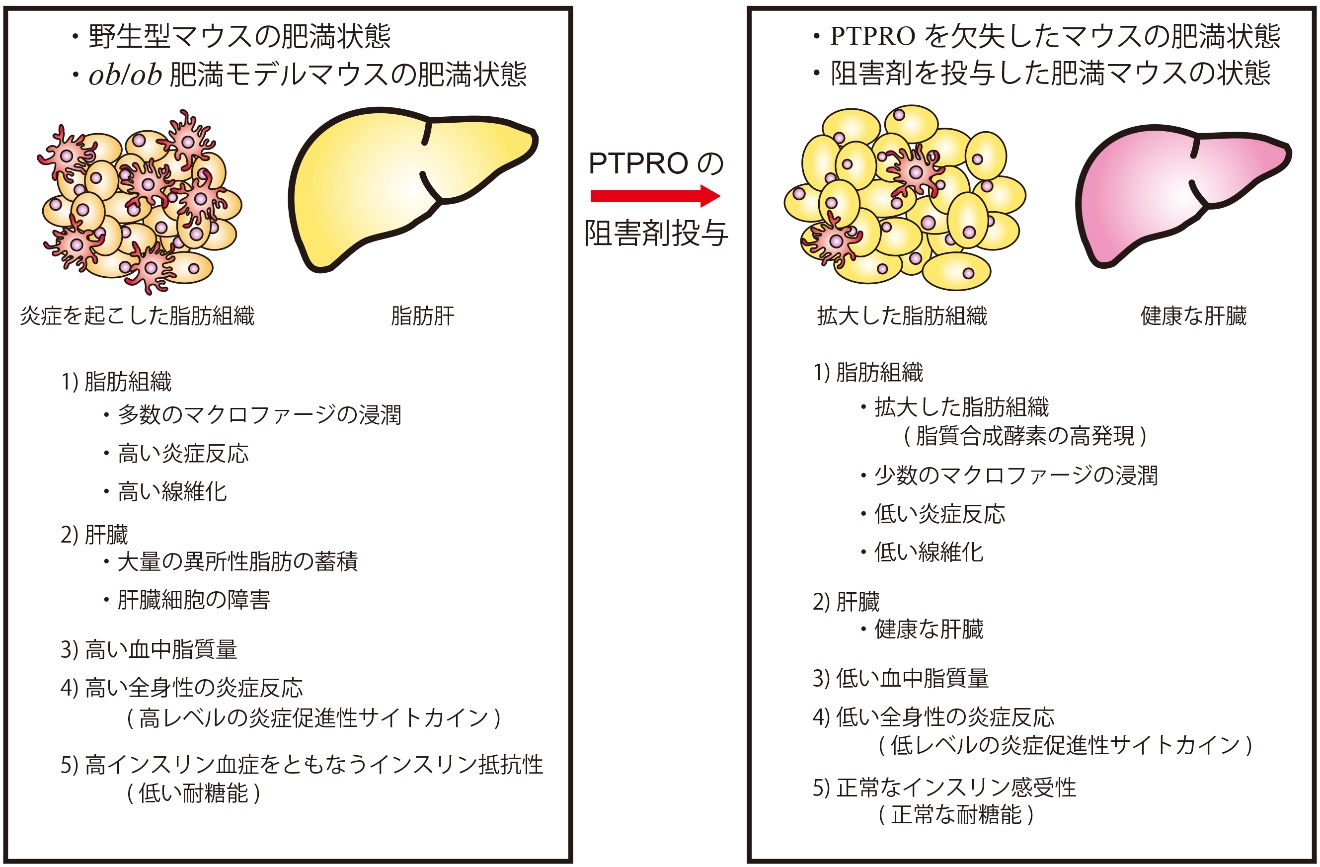
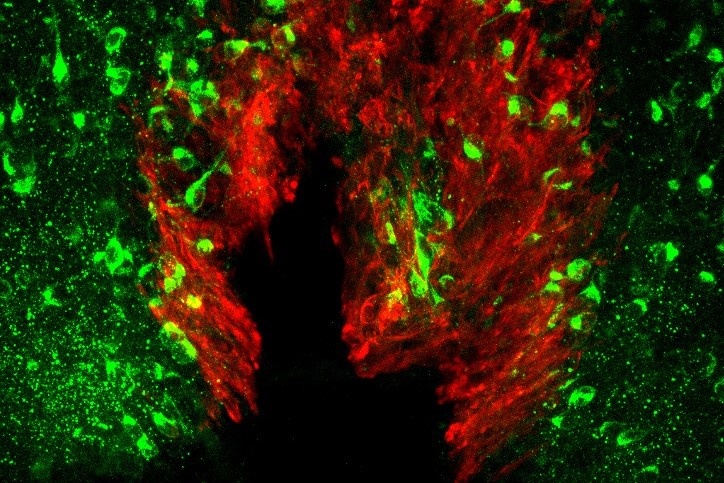
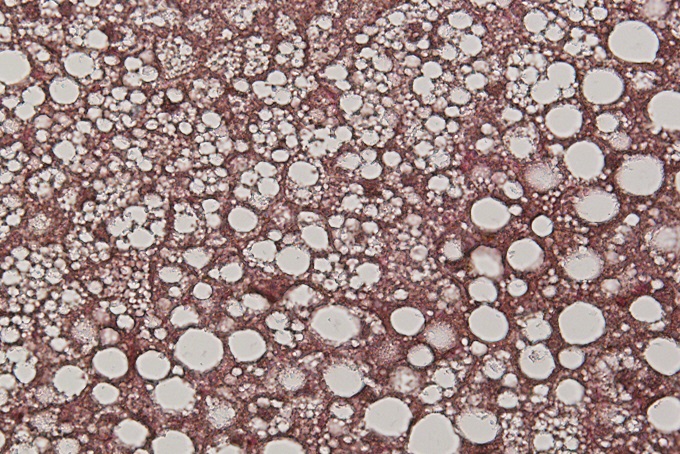
現在、体液恒常性と血圧制御の脳内機構の解明に向けた研究を進めています。 また、肥満(代謝制御)に関する研究も行っています。

People

野田 昌晴
Masaharu Noda, Ph.D.
特任教授
Specially Appointed Professor

松田 隆志
Takashi Matsuda, Ph.D.
特任准教授
Specially Appointed Associate Professor

池田 啓子
Keiko Ikeda, Ph.D.
特定講師
Visiting Associate Professor (Lecturer)

呉 思遠
Wu Siyuan.
研究員
Researcher

久米田 裕子
Yuko Kumeda.
技術支援員
Technical Support Staff

石田 真美
Mami Ishida.
技術支援員
Technical Support Staff

安齋 裕
Yutaka Anzai.
技術支援員
Technical Support Staff

宮原 静
Shizuka Miyahara.
技術支援員
Technical Support Staff

武藤 ゆかり
Yukari Mutoh.
技術支援員
Technical Support Staff

澁谷 有香
Yuka Shibuya.
技術支援員
Technical Support Staff

小野田 陽子
Youko Onoda.
事務支援員
Administrative Support Staff
論文
Publications
(Representative recent ones)
-
Nomura K, Hiyama TY, Sakuta H, Matsuda T, Lin CH, Kobayashi K, Kobayashi K, Kuwaki T, Takahashi K,
Matsui S, Noda M.
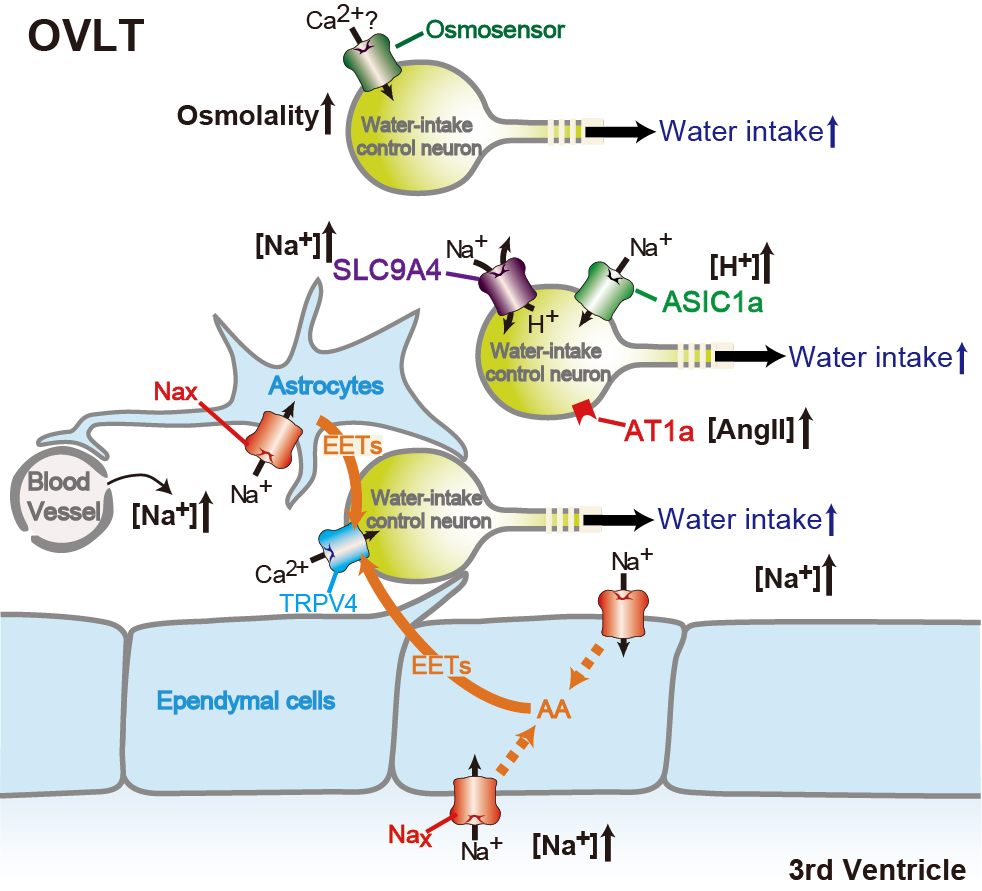
[Na+] Increases in Body Fluids Sensed by Central Nax Induce Sympathetically Mediated Blood Pressure Elevations via H+-Dependent Activation of ASIC1a.
Neuron 101:60-75. doi: 10.1016/j.neuron.2018.11.017. 2019. -
Matsuda T, Hiyama TY, Niimura F, Matsusaka T, Fukamizu A, Kobayashi K, Kobayashi K, Noda M.
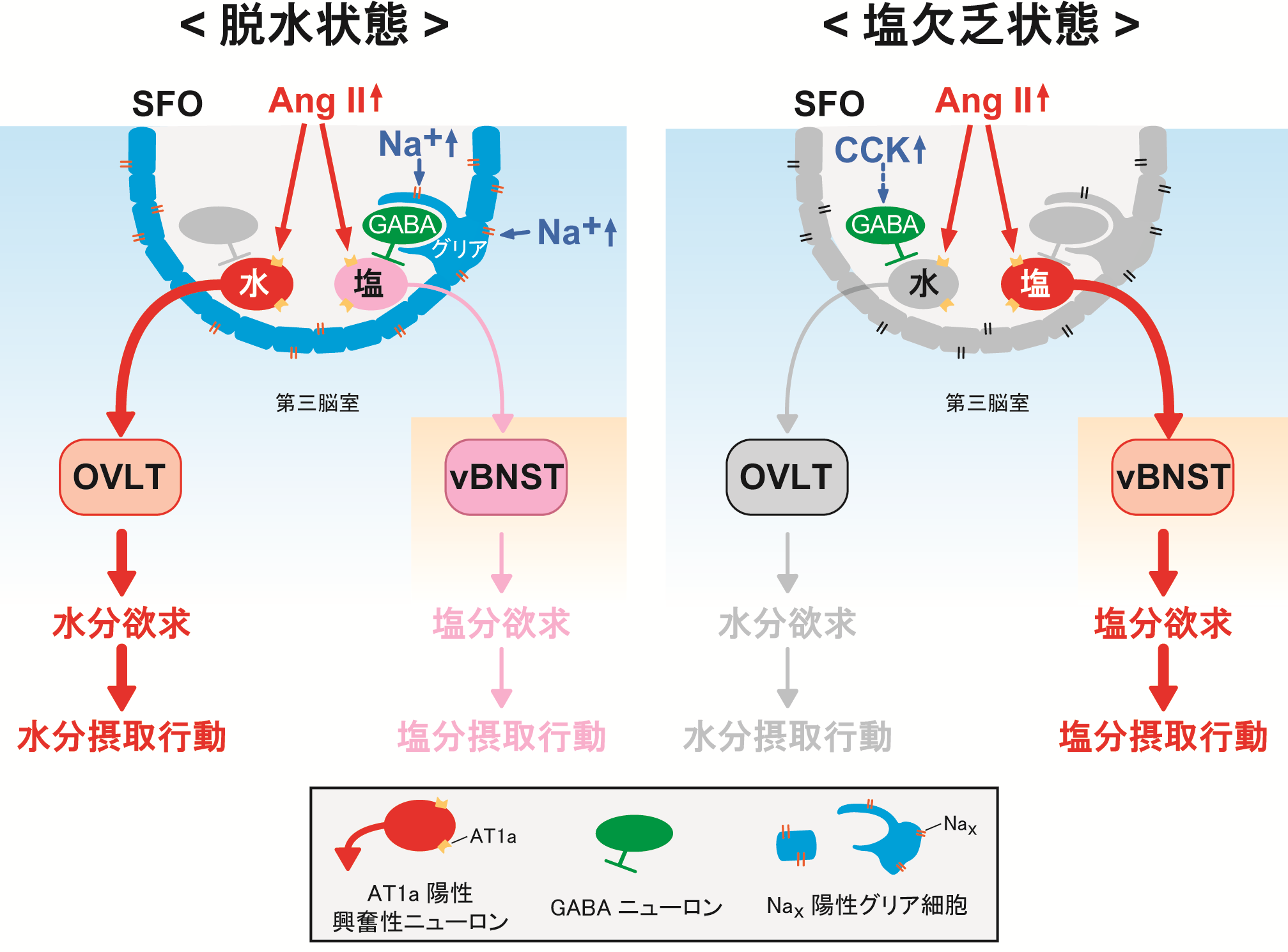
Distinct neural mechanisms for the control of thirst and salt appetite in the subfornical organ.
Nat. Neurosci 2017, 20, 230-241. -
Hiyama TY, Watanabe E, Ono K, Inenaga K, Tamkun MM, Yoshida S, Noda M.
Nax channel involved in CNS sodium-level sensing.
Nature Neurosci. 2002, 5, 511-512.
Contact
-
所在地
〒226-8501
神奈川県横浜市 緑区長津田町4259
東京科学大学 すずかけ台キャンパス
S2棟 4階 East 403 -
最寄駅
東急田園都市線 すずかけ台駅
徒歩5分 -
連絡先
noda.m.19dc@m.isct.ac.jp